Giải Hóa 9 Bài 1: Tính chất hóa học của oxit
Giải bài tập Hóa học 9 bài 1: Tính chất hóa học của oxit có lời giải chi tiết, rõ ràng, hướng dẫn bạn đọc giải chi tiết từng câu hỏi trong SGK Hóa học 9 Bài 1 trang 9. Tài liệu được biên soạn chi tiết. Bài học dễ hiểu giúp các em nâng cao kỹ năng giải bài tập Hóa học 9 từ đó học tốt môn Hóa học hơn. Sau đây mời các bạn tham khảo chi tiết.
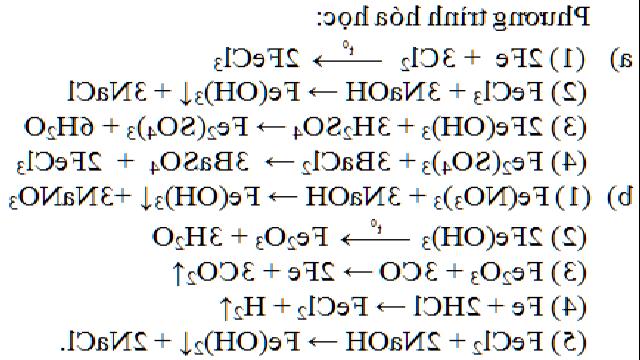
A. Tổng hợp kiến thức Hóa học 9 bài 1: Tính chất hóa học của oxit
I. Phân loại oxit
Dựa vào tính chất hóa học của oxit, người ta phân oxit thành 4 loại:
oxit bazơ:
Các oxit bazơ tan: Na2O, K2O, BaO, CaO, v.v.
Oxit bazơ không tan: CuO, Fe2O3, MgO, v.v.
Oxit axit: SO2, P2O5, CO2, N2O5,…
Oxit lưỡng tính: Al2O3, ZnO,….
Oxit trung tính: CO, NO,…
II. Tính chất hóa học của oxit
1. Tính chất hóa học của oxit bazơ
a) Phản ứng với nước
Ví dụ: CaO(r) H2O → Ca(OH)2 (dd)
BaO(r) H2O → Ba(OH)2 (dd)
b) Phản ứng với oxit axit
Ví dụ: BaO(r) CO2 (k) → BaCO3(r)
c) Phản ứng với axit
Ví dụ: CuO(r) 2HCl (dd) → CuCl2(dd) H2O (lỏng)
2. Tính chất hóa học của oxit axit
a) Phản ứng với nước
Ví dụ:
P2O5(r) 3H2O (lỏng) → 2H3PO4 (dung dịch)
2N2O5 2H2O → 4HNO3
b) Phản ứng với bazơ
Ví dụ:
CO2(k) Ca(OH)2(dd) → CaCO3(r) H2O (lỏng)
SO2 Ba(OH)2 → BaSO3 H2O
c) Phản ứng với oxit bazơ
Ví dụ: BaO(r) CO2(k) → BaCO3(r)
B. Giải bài tập Hóa học 9 bài 1 trang 6
Bài 1 trang 6 sgk hóa học 9
Có các oxit sau: CaO, Fe2O3, SO3. Oxit nào phản ứng được
a) một chút nước?
b) axit clohiđric?
c) natri hiđroxit?
Viết phương trình hóa học.
Đáp án hướng dẫn giải
Oxit bazơ: CaO, Fe2O3.
Oxit axit: SO3
a) Phản ứng với nước
CaO H2O → Ca(OH)2
SO3 H2O → H2SO4
b) Tác dụng với HCl
Fe2O3 HCl → FeCl3 H2O
CaO HCl → CaCl2 H2O
c) Tác dụng với NaOH
SO3 NaOH → Na2SO4 H2O
Bài 2 trang 6 SGK hóa học 9
Có các chất sau: H2O, KOH, K2O, CO2. Kể tên các cặp chất có khả năng tương tác với nhau. Đáp án hướng dẫn giải
Các cặp chất có thể tương tác với nhau là:
H2O K2O → KOH
H2O CO2 → H2CO3
KOH CO2 → K2CO3 H2O
K2O CO2 → K2CO3
Bài 3 trang 6 sổ tay bài 9
Trong số các chất: Canxi oxit, lưu huỳnh đioxit, khí cacbonic, lưu huỳnh trioxit, kẽm oxit, hãy chọn chất thích hợp điền vào các sơ đồ phản ứng sau:
a) Axit sunfuric … → Nước kẽm sunfat
b) Natri hiđroxit … → Natri sunfat Nước
c) Nước… → Axit sunfuric
d) Nước … → Canxi hiđroxit
e) Canxi oxit… → Canxi cacbonat
Hãy dùng công thức hóa học viết tất cả các phương trình hóa học của các sơ đồ phản ứng trên.
Đáp án hướng dẫn giải
a) Axit sunfuric ZnO → Nước sunfat Zn
b) Natri hiđroxit SO3 → Nước natri sunfat
c) Nước SO2 → Axit sunfuric
d) Nước CaO → Canxi hiđroxit
e) Canxi oxit CO2 → Canxi cacbonat
Bài 4 * trang 6 sgk 9
Cho các oxit sau:
CO2, SO2, Na2O, CaO, CuO. Chọn những chất đã được chứng minh là có tác dụng với
a) Nước tạo thành dung dịch axit
b) Nước tạo thành dung dịch bazơ
c) Dung dịch axit tạo thành muối và nước.
d) Dung dịch bazơ tạo thành muối và nước.
Viết các phương trình hóa học. Đáp án hướng dẫn giải
a) Chất phản ứng với nước, tạo thành dung dịch axit: CO2, SO2.
CO2 H2O → H2CO4
SO2 H2O → H2SO3
b) Chất phản ứng với nước tạo thành dung dịch bazơ: Na2O, CaO.
N2O H2O → NaOH
CaO H2O → Ca(OH)2
c) Chất tác dụng với axit tạo muối và nước: Na2O, CaO, CuO.
Na2O 2HCl → 2NaCl H2O
CaO2HCl → CaCl2H2O
CuO2HCl → CuCl2 H2O
d) Chất phản ứng với dung dịch bazơ tạo thành muối và nước: CO2, SO2.
CO2 2NaOH → Na2CO3 H2O
SO2 2NaOH → Na2SO3 H2O
Bài 5 trang 6 sổ tay bài 9
Có hỗn hợp khí CO2 và O2, làm cách nào để lấy O2 từ hỗn hợp trên? Trình bày cách lập và viết phương trình hoá học.
Đáp án hướng dẫn giải
Dẫn hỗn hợp khí CO2 và O2 qua bình đựng dung dịch kiềm dư (NaOH, Ca(OH)2…). CO2 bị giữ lại trong bể vì nó phản ứng với kiềm:
CO2 2NaOH → Na2CO3 H2O
hoặc CO2 Ca(OH)2 → CaCO3 H2O
Khí thoát ra khỏi bình là oxi nguyên chất.
Bài 6 * trang 6 sgk 9
Cho 1,6 gam đồng(II) oxit phản ứng với 100 gam dung dịch axit sunfuric 20%.
a) Viết phương trình hóa học.
b) Tính nồng độ phần trăm của các chất trong dung dịch sau khi phản ứng xảy ra hoàn toàn.
Đáp án hướng dẫn giải
a) Phương trình phản ứng hóa học đang xảy ra
CuO H2S04 → CuSO4 H2O
Phần trăm các chất:
Số mol chất đã dùng:
nCuO = 1,6/80 = 0,02 (mol)
nH2SO4= 20/98 ≈ 0,2 (mol)
Theo phương trình hóa học tính tổng khối lượng CuO tham gia phản ứng và lượng H2SO4 dư.
Khối lượng CuSO4 sinh ra sau phản ứng:
nCuSO4 = nCuO = 0,02 mol,
mCuS04= 160 . 0,02 = 3,2 (g)
Khối lượng H2SO4 còn lại sau phản ứng là:
Số mol H2SO4 tham gia phản ứng là 0,02 mol, có khối lượng là:
mH2SO4 = 98 . 0,02 = 1,96 (g)
Khối lượng H2SO4 còn dư sau phản ứng:
mH2SO4 dư= 20 – 1,96 = 18,04 (g)
Nồng độ phần trăm của các chất trong dung dịch sau phản ứng:
Khối lượng dung dịch sau phản ứng:
mdd= 100 1,6= 101,6 (g)
Nồng độ CuSO4 trong dung dịch:
C% CuSO4 = 3,2*100%/101,6 3,15%
Nồng độ của H2SO4 dư trong dung dịch:
C%H2SO4= 18,04x 100%/101,6 ≈ 17,76%
C. Mọi người cũng hỏi
Bài tập Giải Hóa 9 Bài 1 yêu cầu giải gì?
Trả lời: Bài tập Giải Hóa 9 Bài 1 yêu cầu học sinh giải một bài toán hóa học có thể liên quan đến các khái niệm, phản ứng hóa học hoặc tính toán về lượng chất trong phản ứng.
Bài tập Giải Hóa 9 Bài 1 có độ khó như thế nào?
Trả lời: Độ khó của bài tập Giải Hóa 9 Bài 1 phụ thuộc vào nội dung bài tập và kiến thức đã học trước đó. Bài tập này có thể đơn giản đến khó tùy thuộc vào yêu cầu và nội dung cụ thể.
Cần chuẩn bị gì để giải tốt Bài 1 trong bài tập Giải Hóa 9?
Trả lời: Để giải tốt Bài 1 trong bài tập Giải Hóa 9, học sinh cần nắm vững kiến thức cơ bản về các phản ứng hóa học, biết sử dụng công thức và tính toán chất hóa học trong các phản ứng.
Bài tập Giải Hóa 9 Bài 1 giúp học sinh rèn luyện kỹ năng gì?
Trả lời: Bài tập Giải Hóa 9 Bài 1 giúp học sinh rèn luyện kỹ năng giải bài toán hóa học, làm quen với các loại phản ứng hóa học, và cải thiện khả năng tính toán trong lĩnh vực hóa học. Nó cũng giúp học sinh hiểu rõ hơn về ứng dụng của kiến thức hóa học trong cuộc sống thực tế.
Bên cạnh các câu bài tập SGK 9 bài 1, nhằm nâng cao, củng cố cũng như vận dụng các kiến thức lý thuyết Sinh 9 bài 1, các em cần làm thêm các dạng bài tập giải vở bài tập SGK. 9 Bài 1. Giúp người đọc nắm được các phương pháp giải toán. ACC GROUP đã tổng hợp hướng dẫn bạn đọc Giải bài tập SBT Hóa học 9 tập 1 tại:
Giải Sách Bài Tập Hóa Học 9 Bài 1
Trên đây ACC GROUP đã gửi tới bạn đọc Giải pháp Hóa học 9 bài 1: Tính chất hóa học của oxit. Hi vọng tài liệu sẽ giúp ích cho các bạn học sinh trong quá trình học tập, làm bài tập tốt hơn và nắm chắc nội dung bài học về oxit. Để xem lời giải các bài toán dưới đây, mời các bạn vào chuyên mục Giải bài tập Hóa học 9 trên ACC GROUP. Phần tổng hợp lời giải Hóa học 9 theo từng bài giúp học sinh dễ dàng theo dõi trong quá trình tự học của mình.
Ngoài tài liệu trên, các em còn có thể tham khảo thêm Trắc nghiệm hóa học 9, Giải bài tập Hóa học 9, Sách bài tập Hóa học 9 để giúp rèn luyện thêm kỹ năng giải bài tập và làm bài tốt hơn. Chúc các bạn học tốt.
